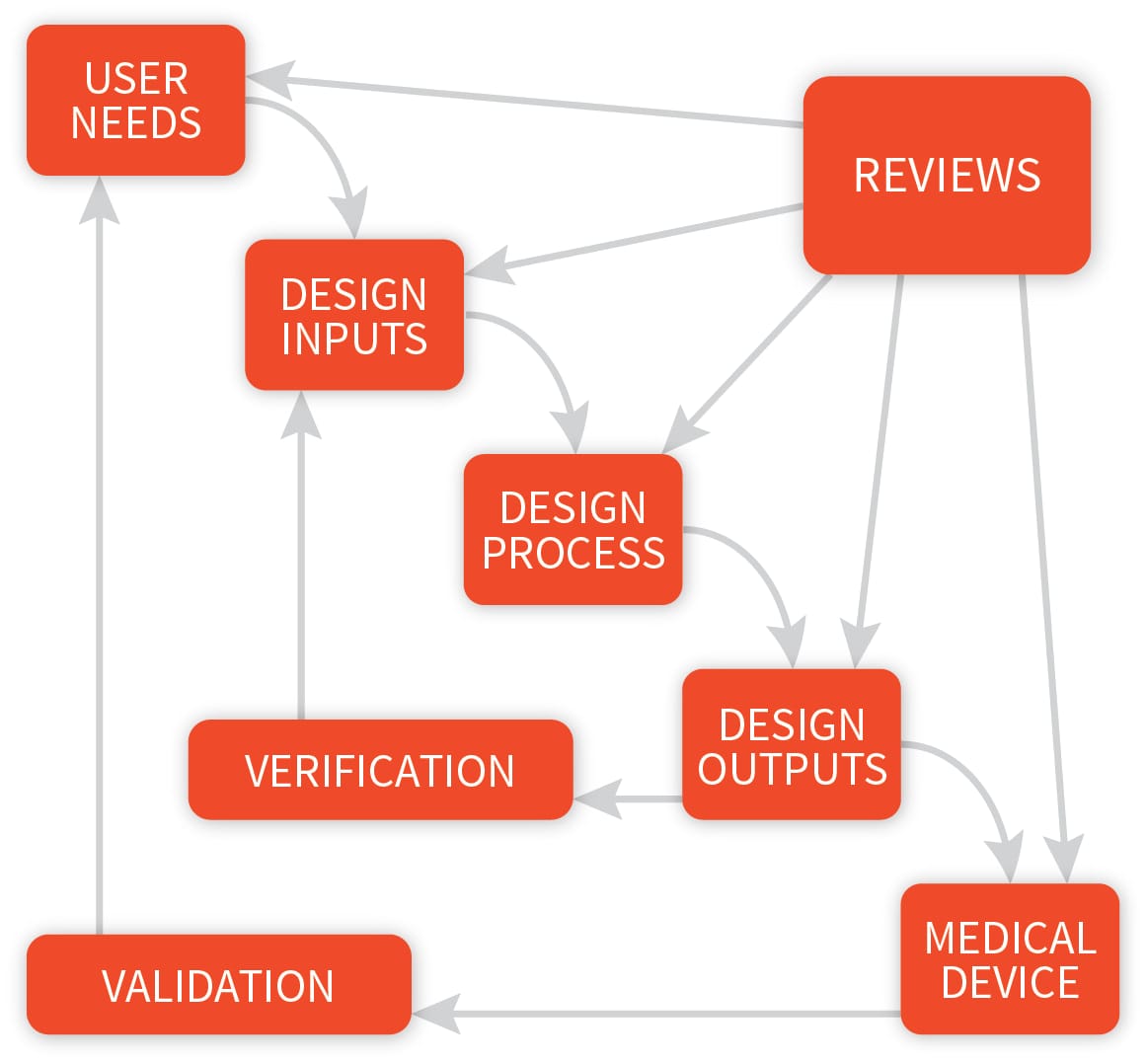
Für die Entwicklung eines leistungsstarken Medizingerätes sind Designkontrollen in der frühen Entwicklungsphase essentiell. Die Designkontrolle ist Teil eines effektiven Risikomanagements, um ein sicheres Produkt rechtzeitig und innerhalb des Budgets auf den Markt zu bringen.
Designkontrolle für Altlastensanierung und neue Entwicklungprojekte
Designkontrollen müssen bereits in der frühen Entwicklungsphase implementiert werden. Ein ordnungsgemäß Designkontrolleprozess stellt nicht nur die Einhaltung der FDA CFR 21 820.30 sicher, sondern bietet auch ein Werkzeug und einen Rahmen für die Entwicklung eines erfolgreiches und leistungsstarken Gerätes.
Wir verfügen über umfangreiche Erfahrung im Bereich Medizinprodukte von Designkontrollen und Dokumentationen für die Entwicklung neuer Produkte oder die Korrektur bestehender Design History Files (DHF), um Compliance-Lücken zu schließen.
- Unsere Erfahrung umfasst:
- Orthopädie- und Osteosynthesegerät
- Gerät mit Software
- Endoskopische Vorrichtung
- Diagnosegeräte
- Aktive Geräte
- Kombinationsprodukte
Designkontrolle ist eine gute Praxis
Einfach ausgedrückt, ist es die vollständige Kontrolle über die Designentwicklung Ihres Produkts. Designkontrollen bezeichnen die Anwendung einer formalen Methodik auf die Durchführung von Produktentwicklungsaktivitäten.
Designkontrollen machen eine systematische Bewertung das Design zu einem integralen Bestandteil der Entwicklung. Infolgedessen werden Mängel bei den Anforderungen an den Designeinsatz und Diskrepanzen zwischen den vorgeschlagenen Entwürfen und Anforderungen früher im Entwicklungsprozess sichtbar gemacht und korrigiert.
Designkontrollen erhöhen die Wahrscheinlichkeit, dass das in die Produktion überführte Design in ein Gerät umgesetzt wird, das für den vorgesehenen Verwendungszweck geeignet ist.
In der Praxis bieten Designkontrollen Mangern und Designern eine verbesserte Transparenz des Designprozesses. Mit verbesserter Trasparenz sind Managern in der Lage den Designprozess effektiver zu steuern, das heißt Probleme früher zu erkennen, Korrekturen vorzunehmen und die Ressourcenzuweisung anzupassen.
Designkontrollen – Was sind sie?
Eine Reihe von Qualitätskontrollpraktiken und -verfahren, die in den Design- und Entwicklungsprozess integriert sind.
Kontrolle des Designprozesses, um sicherzustellen, dass die Gerätespezifikationen erfüllt werden:
- Benutzerbedürfnisse
- Bestimmungsgemäßer Gebrauch
Designkontrollen – Warum?
- Es ist eine vorteilhafte Geschäftspraxis.
- Systematischer Prozess
- Probleme frühzeitig erkennen
- Korrekturen vornehmen
- Ressourcenzuordnung anpassen
- "Einhaltung auf einen Blick"
- Die Kosten für die Behebung von Konstruktionsfehlern sind geringer, wenn Fehler frühzeitig erkannt werden.
- Projektzeitpläne
Designkontrollen sind vorgeschrieben durch:
21CFR 820.30 in den USA (Regelung des Qualitätssystems)
93/42/EWG in der EU (MDD - Medizinprodukte-Richtlinie)
Neuer MDR 2017/745
ISO13485:2016 (Qualitätsmanagementsysteme) in Europa und weltweit.
RISIKOMANAGEMENT FÜR ALT- UND NEUBAUPROJEKTE
Um die Anforderungen des internationalen Standards zu erfüllen und sicherzustellen, dass Ihr Unternehmen ein sicheres, effektives Produkt rechtzeitig und innerhalb des Budgets auf den Markt bringt, benötigen Sie eine erfolgreiche Implementierung Ihres Risikomanagementsystems. Wir können Ihr Unternehmen dabei unterstützen und unterstützen, dies auf die richtige Weise zu tun.
Wir bieten die folgenden Dienstleistungen an:
- Erstellung einer Risikodatei nach ISO 14971:2012 für neu entwickelte Geräte
- Sanierung bestehender Risikomanagement-Dateien (für Medizinprodukte und Kombinationsprodukte)
- Gap Analysis Services zur Überprüfung und Verbesserung des tatsächlichen Konformitätsgrades Ihres Risikomanagementprozesses nach ISO 14971:2012
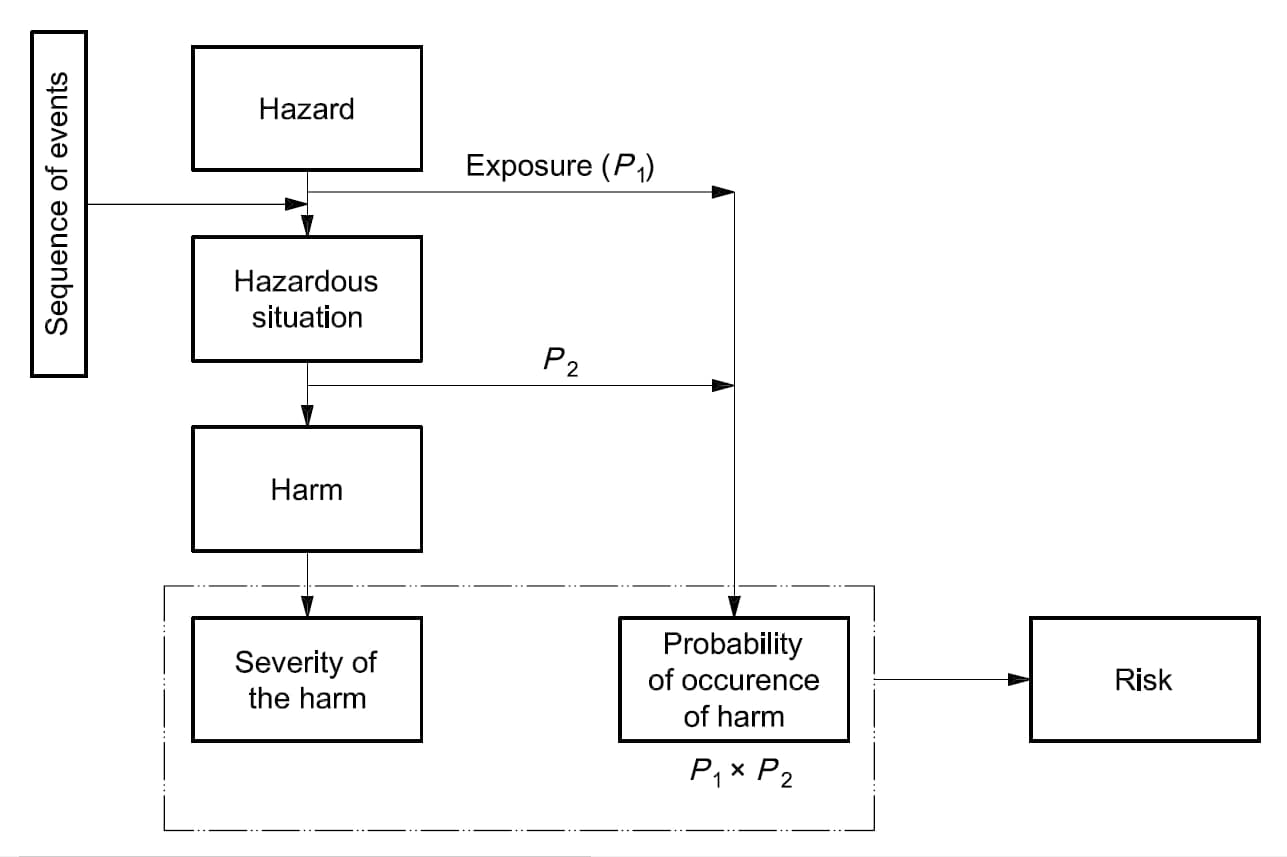
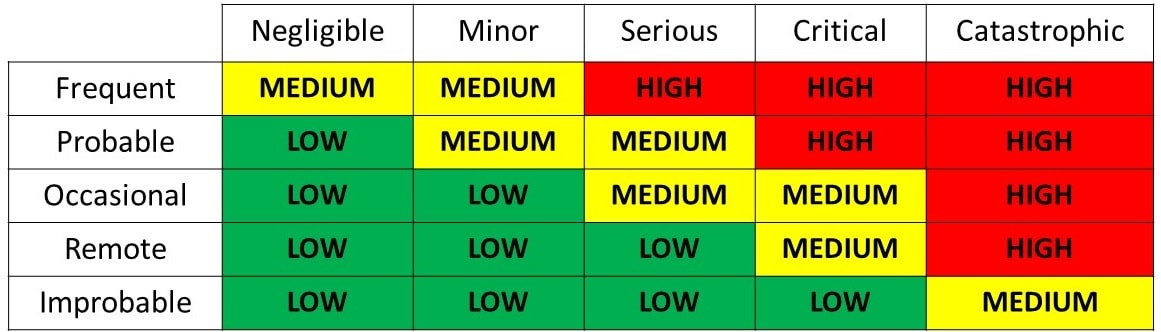
Die Anforderungen der ISO 14971:2012 gelten für alle Phasen des Lebenszyklus eines Medizinproduktes.
Risikomanagement ist die systematische Anwendung von Managementrichtlinien, -verfahren und -praktiken auf die Aufgaben der Identifizierung, Analyse, Bewertung, Kontrolle, Überwachung und Überprüfung von Risiken.
Über uns
Wir sind ein Team von Subject Matter Experts (SMEs) mit eine langjähriger Erfahrung in der Medizingeräte und Pharmaindustrie. Unsere Beraterteam arbeitete für die größten Unternehmen und Marktführer und unterstützte sie bei großen DHF-Sanierungsprojekten und bei neuen Entwicklungsprojekten verfügen.